Từ những con chuột đực kỳ lạ đến Nobel Y sinh 2025
Từ những thí nghiệm trên chuột con bị cắt bỏ tuyến ức, Giáo sư Shimon Sakaguchi (Đại học Osaka, Nhật Bản) phát hiện “lớp phòng thủ thứ hai” của hệ miễn dịch - nhóm tế bào T điều hòa giúp cơ thể không tự tấn công chính mình.
Sáu năm sau, Tiến sĩ Mary E. Brunkow (Institute for Systems Biology, Seattle, Mỹ) và Tiến sĩ Fred Ramsdell (hiện làm việc tại Công ty Công nghệ sinh học Sonoma Biotherapeutics, San Francisco, Mỹ), tìm ra mảnh ghép hoàn thiện bức tranh ấy.
Chuỗi phát hiện đã mở ra kỷ nguyên mới cho y học miễn dịch và mang về cho họ Giải Nobel Y sinh 2025.

Các nhà khoa học đạt giải Nobel Y sinh năm 2025. Ảnh: Nobel Prize.
Từ con chuột bất thường đến đột phá di truyền học
Hệ miễn dịch của con người là “kiệt tác tiến hóa”, đây là bộ máy bảo vệ phức tạp giúp chúng ta sống sót trước hàng nghìn virus, vi khuẩn và tác nhân gây bệnh khác mỗi ngày. Tuy nhiên, nếu không được kiểm soát chặt chẽ, sức mạnh ấy có thể quay ngược lại, tấn công chính cơ thể. Làm thế nào để hệ miễn dịch phân biệt đâu là “kẻ thù” cần tiêu diệt, đâu là “người nhà” cần được bảo vệ, từ lâu vẫn là một bí ẩn lớn của y học.
Trong bức tranh phức tạp đó, tế bào T là những “chiến binh” giữ vai trò trung tâm. Một số tế bào T có nhiệm vụ cảnh báo khi phát hiện mầm bệnh, số khác trực tiếp tiêu diệt tế bào bị nhiễm virus hoặc khối u. Tuy nhiên, trong quá trình trưởng thành, vẫn có những tế bào T “lạc đường”, nhận nhầm mô của chính cơ thể là kẻ thù.
Trước đây, giới khoa học tin rằng quá trình “kiểm duyệt” trong tuyến ức (thymus), gọi là dung nạp trung ương, đã loại bỏ hoàn toàn các tế bào T sai lệch. Nhưng thực tế, một số vẫn “lọt lưới”. Chính lúc này, phát hiện của GS Shimon Sakaguchi đã thay đổi mọi thứ.
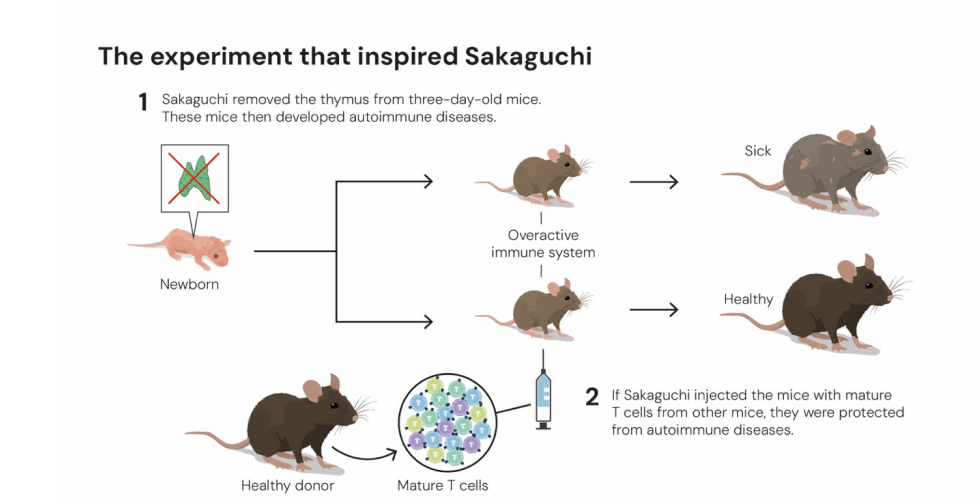
Thí nghiệm trên chuột giúp nhà khoa học khám phá được khả năng đặc biệt của tế bào T.
Từ thí nghiệm cắt bỏ tuyến ức trên chuột con, ông Sakaguchi nhận thấy những con bị mất cơ quan này sớm phát triển hàng loạt bệnh tự miễn, dấu hiệu cho thấy hệ miễn dịch đã “vượt kiểm soát”.
Ông tìm ra một nhóm tế bào T đặc biệt có khả năng giữ trật tự, làm dịu phản ứng miễn dịch, gọi là tế bào T điều hòa (regulatory T cells, Tregs). Năm 1995, công bố của ông trên The Journal of Immunology đã chính thức xác nhận sự tồn tại của lớp “vệ sĩ” này.
Ở bên kia Thái Bình Dương, hai nhà khoa học Mary Brunkow và Fred Ramsdell lại theo đuổi một bí ẩn khác. Trong quá trình nghiên cứu di truyền ở Oak Ridge (Mỹ), họ phát hiện một dòng chuột đực kỳ lạ - da bong tróc, hạch phình to và chết chỉ sau vài tuần. Dòng chuột này được đặt tên là scurfy.
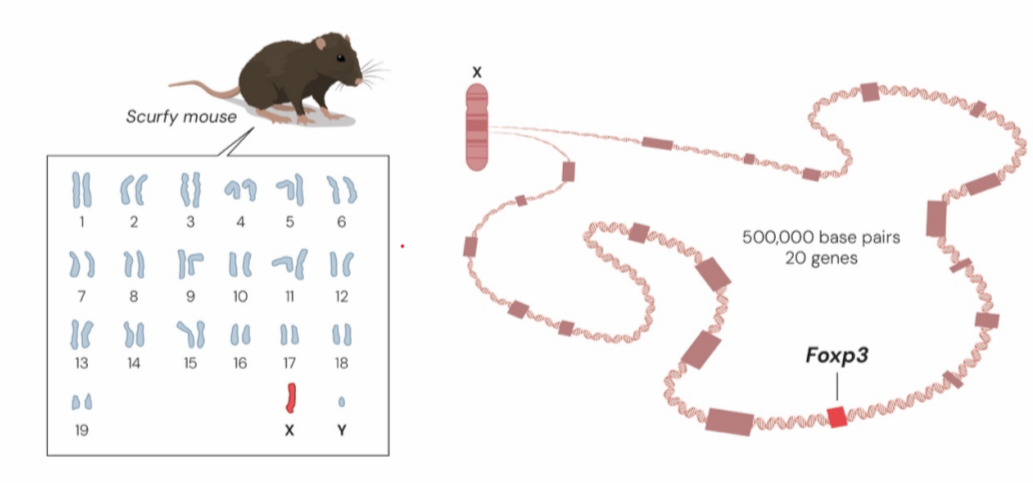
Các nhà khoa học lần lượt kiểm tra từng gene một. Chỉ đến gene thứ hai mươi, cũng là gene cuối cùng, họ mới có thể reo lên “bingo”. Sau nhiều năm miệt mài nghiên cứu, cuối cùng họ đã tìm ra đột biến gây nên hiện tượng scurfy.
Sau nhiều năm kiên trì, Brunkow và Ramsdell xác định thủ phạm là một đột biến trên nhiễm sắc thể X nằm ở một gene hoàn toàn mới, mà họ đặt tên là Foxp3. Khi gene này bị lỗi, các tế bào T mất khả năng tự điều hòa, khiến hệ miễn dịch tấn công chính cơ thể.
Phát hiện này nhanh chóng được liên hệ với một bệnh hiếm gặp ở người - hội chứng IPEX. Năm 2001, hai nhà khoa học công bố trên Nature Genetics rằng đột biến gen FOXP3 chính là nguyên nhân gây bệnh ở cả người và chuột. Từ đó, giới khoa học nhận ra mối liên hệ chặt chẽ giữa gene FOXP3 và các tế bào T điều hòa mà Sakaguchi từng mô tả.
“Bộ phanh” sinh học của cơ thể
Chỉ hai năm sau phát hiện đột phá của Mary Brunkow và Fred Ramsdell, Shimon Sakaguchi cùng các cộng sự đã hoàn thiện bức tranh còn dang dở: họ chứng minh FOXP3 chính là “công tắc điều khiển” sự hình thành của tế bào T điều hòa - lớp tế bào có vai trò giữ cho hệ miễn dịch luôn trong trạng thái cân bằng.
FOXP3 nằm trên nhiễm sắc thể X và tạo ra một loại protein điều hòa gene. Hiểu đơn giản, đó là “bộ chỉ huy” có nhiệm vụ bật những gene cần thiết và tắt những gene nguy hiểm để giữ cho hệ thống miễn dịch hoạt động đúng mức.
Trong tế bào T, FOXP3 kích hoạt các gene giúp tế bào biết cách kiềm chế phản ứng, chẳng hạn, các gene tạo ra chất có khả năng làm dịu viêm. Cùng lúc đó, FOXP3 tắt đi những gene kích thích phản ứng tấn công mạnh, ngăn hệ miễn dịch phản ứng quá đà.
Nhờ cơ chế này, FOXP3 hoạt động như bộ phanh sinh học của cơ thể. Nếu ví hệ miễn dịch là một đội quân tinh nhuệ, thì tế bào T điều hòa chính là lực lượng giúp nó dừng lại đúng lúc sau khi đã hoàn thành nhiệm vụ tiêu diệt mầm bệnh.
Nhiều hứa hẹn cho y học hiện đại
Từ việc làm sáng tỏ vai trò của FOXP3 và tế bào T điều hòa, ba nhà khoa học đã đặt nền móng cho nhiều hướng điều trị tiên tiến. Công trình này cũng được chuyển hóa thành các phương pháp điều trị tiềm năng, đang trong giai đoạn thử nghiệm lâm sàng.
Trong ung thư, nơi tế bào T điều hòa đôi khi lại “bảo vệ” khối u khỏi sự tấn công của hệ miễn dịch, các nhà khoa học đang tìm cách vô hiệu hóa lớp lá chắn này để giúp cơ thể nhận diện và tiêu diệt tế bào ung thư hiệu quả hơn.
Ngược lại, trong các bệnh tự miễn như lupus hay tiểu đường type 1, khi hệ miễn dịch nhận nhầm mô của chính mình là kẻ lạ, hướng điều trị lại là kích hoạt hoặc tăng số lượng tế bào T điều hòa. Các nhà nghiên cứu đang thử dùng những phân tử như interleukin-2 để nuôi dưỡng nhóm tế bào này, hoặc nhân chúng lên trong phòng thí nghiệm rồi truyền trở lại cơ thể bệnh nhân, giúp “xoa dịu” phản ứng miễn dịch quá mức.
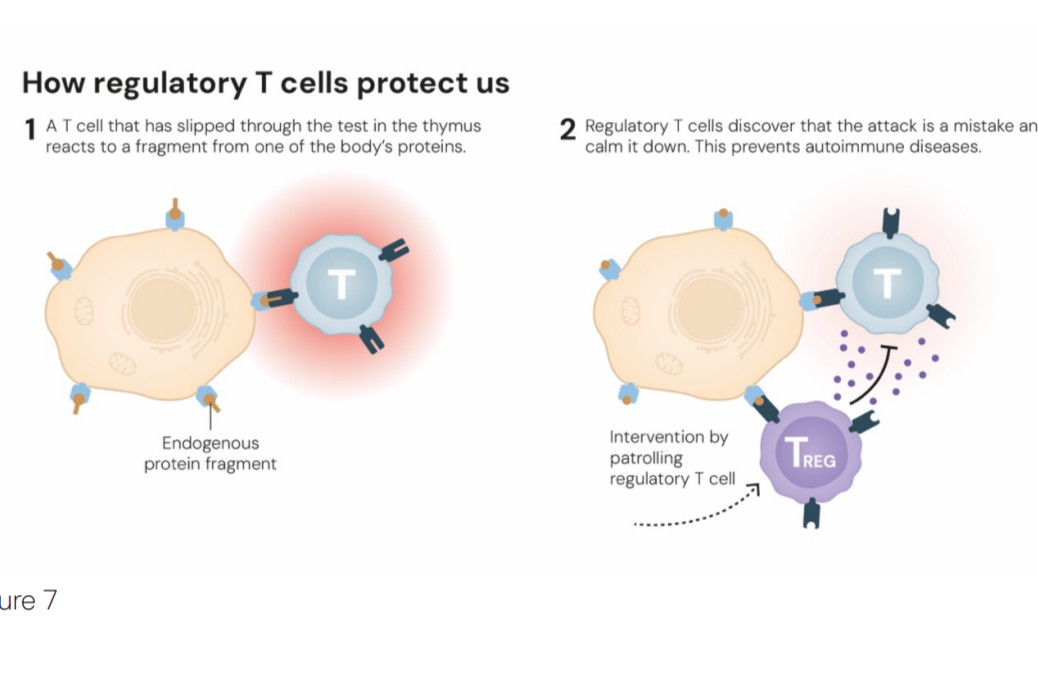
Những tế bào này ngăn không cho các tế bào T khác vô tình tấn công mô của chính cơ thể, một cơ chế quan trọng được gọi là dung nạp miễn dịch ngoại biên.
Với ghép tạng, ý tưởng còn tiến xa hơn.
Các nhà khoa học đang thử “lập trình” tế bào T điều hòa sao cho chúng nhận biết chính xác cơ quan được cấy ghép, từ đó giúp cơ thể chấp nhận mô mới mà không cần dùng quá nhiều thuốc ức chế miễn dịch. Cách làm này có thể giảm nguy cơ đào thải và kéo dài tuổi thọ của tạng ghép.
“Khi bức màn bí ẩn quanh tế bào T điều hòa dần được vén lên, tiềm năng ứng dụng 'sức mạnh kiểm soát' ấy trong y học ngày càng rõ rệ, giúp con người chống lại hai mối đe dọa song hành: sự tấn công nhầm lẫn của bệnh tự miễn và những tổn thương do phản ứng miễn dịch quá mức gây ra”, Ủy ban Nobel thuộc Viện Karolinska (Thụy Điển) nhấn mạnh.
Kỳ Duyên
Nguồn Znews : https://lifestyle.znews.vn/tu-nhung-con-chuot-duc-ky-la-den-nobel-y-sinh-2025-post1591261.html
Tin khác

Phát hiện 'vệ sĩ tàng hình' của hệ miễn dịch, ba nhà khoa học nhận giải Nobel Y học 2025

2 giờ trước

Nobel Y học 2025 vinh danh công trình về dung nạp miễn dịch ngoại biên

4 giờ trước

Lộ diện tử huyệt của tế bào ung thư

5 giờ trước

Tái hiện chân thực khuôn mặt thiếu nữ Anglo-Saxon thế kỷ thứ 7

một giờ trước

Vì sao thanh kiếm chuôi bát giác 3.000 năm tuổi được xem là 'vô giá'?

một giờ trước

Sau 3 siêu trăng huyền diệu, bầu trời 2025 còn tặng gì cho nhân loại?

2 giờ trước
