Vắc xin một liều: Giải pháp tương lai cho cuộc chiến chống vi rút
Theo Newsweek, vắc xin thử nghiệm được thiết kế bao gồm kháng nguyên protein của HIV kèm theo hai tá dược gồm nhôm hydroxit (alum) và các hạt nano SMNP (Saponin-Mesoporous Nanoparticle). Nhôm hydroxit vốn được dùng rộng rãi để kích thích phản ứng miễn dịch bẩm sinh, trong khi SMNP chứa saponin tự nhiên đã được FDA công nhận, bổ sung thêm một phân tử chủ động thúc đẩy quá trình viêm, yếu tố quan trọng để khởi động và duy trì phản ứng miễn dịch.
Thí nghiệm trên chuột cho thấy, khi tiêm vắc xin bổ trợ kép, kháng nguyên HIV không bị phân hủy ngay lập tức mà tích tụ trong hạch bạch huyết lên đến 28 ngày. Hạch bạch huyết là “nhà máy” sản xuất tế bào B, nơi các tế bào này liên tục tiếp xúc với kháng nguyên để học hỏi và tinh chỉnh kháng thể. Nhờ đó, tế bào B có thêm thời gian để chọn lọc và tạo ra kháng thể có độ đặc hiệu và đa dạng cao hơn.
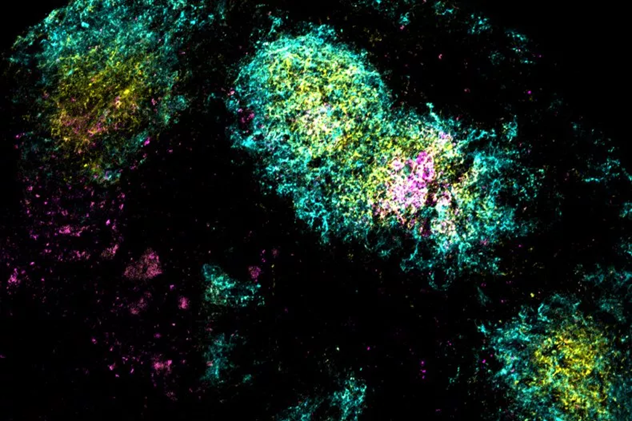
Hình ảnh kháng nguyên vắc xin (màu hồng) tích tụ bên trong nang tế bào B (màu lục lam) - Ảnh: MIT
Các nhà nghiên cứu tách tế bào B từ hạch bạch huyết của chuột 14 và 28 ngày sau tiêm, rồi phân tích biểu hiện RNA để đánh giá mức độ đa dạng của tế bào. Kết quả cho thấy, so với nhóm chỉ dùng alum hoặc chỉ dùng SMNP, nhóm chuột nhận tá dược kép sản sinh gấp đôi số dòng tế bào B độc đáo, cũng như đa dạng hơn về kháng thể hướng đến nhiều vùng khác nhau trên protein HIV.
Thử thách bảo vệ với vi rút mô phỏng HIV (SHIV) cho kết quả rõ rệt: chuột đã tiêm bổ trợ kép cho thấy mức tải lượng vi rút trong máu giảm mạnh chỉ sau một liều, đồng thời duy trì khả năng trung hòa vi rút cao trong suốt 8 tuần quan sát. Trong khi đó, nhóm đối chứng tiêm một tá dược đơn hoặc không có tá dược chỉ có đáp ứng trung bình và không bền bỉ.
Theo Giáo sư J. Christopher Love (MIT), ưu điểm chính của phương pháp là tận dụng các tá dược đã được hiểu rõ về tính an toàn và cơ chế hoạt động. “Chúng tôi không cần phát triển công nghệ mới, chỉ cần kết hợp khéo léo hai tá dược đã có sẵn để kéo dài thời gian tiếp xúc với kháng nguyên và tối ưu hóa quá trình hình thành kháng thể”, ông cho biết.
Các tác giả nghiên cứu lưu ý rằng cơ chế tương tự có thể áp dụng cho nhiều loại vắc xin khác dựa trên kháng nguyên protein, như vắc xin COVID-19 hay cúm. Việc chỉ cần liều duy nhất sẽ giảm chi phí tiêm chủng, tăng tính tuân thủ của người dân và hạn chế áp lực lên hệ thống y tế, nhất là trong các khu vực khó tiếp cận cơ sở y tế.
Trước đây, vắc xin protein thường yêu cầu tiêm hai hoặc ba liều cách nhau nhiều tuần để đạt đề kháng đủ mạnh, đồng thời phụ thuộc vào việc bổ sung thêm các tá dược phức tạp hoặc công nghệ phân phối mới như lipid nano. Phương pháp bổ trợ kép đơn giản hơn, có thể tích hợp vào quy trình sản xuất vắc xin hiện hành mà không phải thay đổi khung hình thức.
Mặc dù kết quả trên chuột rất hứa hẹn, các nhà khoa học lưu ý cần đánh giá độc tính và dược động học trong mô hình lớn hơn, gồm cả khỉ và cuối cùng là thử nghiệm lâm sàng trên người. Đặc biệt, cần xác định liều tối ưu để cân bằng giữa tính an toàn và hiệu lực miễn dịch, cũng như khả năng mở rộng sản xuất SMNP ở quy mô công nghiệp.
Trong bối cảnh nhiều bệnh nhiễm trùng mới nổi và xu hướng kháng thuốc tăng lên, việc phát triển vắc xin một liều, ít phụ thuộc vào lưu trữ lạnh và có thể bảo quản dễ dàng sẽ giúp tăng khả năng phản ứng kịp thời trước các đợt bùng phát. Bổ trợ kép là một trong những hướng đi tiết kiệm chi phí và nhanh chóng triển khai.
Nghiên cứu vắc xin HIV với tá dược kép của MIT và Scripps đã chứng tỏ rằng chỉ một mũi tiêm có thể kích hoạt phản ứng miễn dịch mạnh mẽ và bền vững. Cơ chế giữ kháng nguyên lâu trong hạch bạch huyết, cùng khả năng đa dạng hóa tế bào B, mở ra bước tiến trong thiết kế vắc xin protein thế hệ mới. Nếu được xác nhận qua các giai đoạn thử nghiệm tiếp theo, đây có thể là giải pháp đột phá không chỉ cho HIV mà còn cho nhiều bệnh truyền nhiễm khác.
Hoàng Vũ
Nguồn Một Thế Giới : https://1thegioi.vn/vac-xin-mot-lieu-giai-phap-tuong-lai-cho-cuoc-chien-chong-vi-rut-234052.html
Tin khác

Người phụ nữ mang nhóm máu cực hiếm chưa từng được ghi nhận trong y văn thế giới

3 giờ trước

Tư thế ngủ có thể giảm sưng và cải thiện sức khỏe tim mạch

3 giờ trước

Lò sản xuất đồng vị và dược phóng xạ hỏng khiến máy chụp PET/CT 'đắp chiếu'

5 giờ trước

Mỹ phê duyệt thuốc tiêm ngừa HIV mới

9 giờ trước

Bác sĩ cảnh báo nguy hiểm khi sử dụng nước giếng nấu ăn

một giờ trước

Câu chuyện phía sau thử nghiệm thay đổi cuộc đời người bệnh tiểu đường

2 giờ trước
